Układ okresowy pierwiastków jest tablicą przedstawiającą wszystkie znane pierwiastki chemiczne. Uporządkowanie pierwiastków w układzie jest ściśle związane z ich właściwościami fizyko-chemicznymi. Podobieństwa pomiędzy poszczególnymi grupami pierwiastków na przestrzeni lat zauważało wielu naukowców, natomiast pierwszym, który ułożył je na kształt współczesnego układu okresowego był Dmitrij Mendelejew.
Rozmieszczenie pierwiastków w układzie okresowym
Rozmieszczenie pierwiastków w układzie okresowym opiera się na sformułowanym przez Mendelejewa prawie okresowości, które brzmi:
Właściwości pierwiastków chemicznych uporządkowanych zgodnie ze wzrastająca liczbą atomową powtarzają się okresowo.
Tak więc podstawą uporządkowania pierwiastków jest ich liczba atomowa, która określa liczbę protonów znajdujących się w jądrze, a tym samym liczbę elektronów rozlokowanych na powłokach elektronowych niezjonizowanego atomu. I to właśnie liczba elektronów oraz ich rozmieszczenie, decyduje o właściwościach chemicznych poszczególnych pierwiastków.
Elektrony są umiejscowione na powłokach wokół jądra pierwiastka. Każda z powłok ma swoją pojemność tj. maksymalną liczbę elektronów, jaka może się na niej znajdować. Jest to uwarunkowane wartością głównej liczny kwantowej poszczególnych powłok. Co więcej, każda z powłok dzieli się na podpowłoki (a te na orbitale), które również posiadają swoją pojemność, ta z kolei określana jest przez wartość pobocznej liczny kwantowej. Oznaczenia oraz pojemności poszczególnych powłok i podpowłok obrazują poniższe tabele:
| Symbol powłoki | Główna liczba kwantowa n | Maksymalna liczna elektronów na powłoce (2n2) | Podpowłoki |
| K | 1 | 2 | s |
| L | 2 | 8 | s, p |
| M | 3 | 18 | s, p, d |
| M | 4 | 32 | s, p, d, f |
| O | 5 | 50 | s, p, d, f, g |
| P | 6 | 72 | s, p, d, f, g, h |
| Q | 7 | 98 | s, p, d, f, g, h, i |
| Symbol podpowłoki | Poboczna liczba kwantowa l | Maksymalna liczba elektronów na podpowłoce (4l+2) |
| s | 0 | 2 |
| p | 1 | 6 |
| d | 2 | 10 |
| f | 3 | 14 |
| g | 4 | 18 |
| h | 5 | 22 |
| i | 6 | 26 |
Rozmieszczanie elektronów na kolejnych powłokach następuje w momencie, gdy poprzednie są całkowicie zapełnione. Najbardziej zewnętrzna, ostatnia powłoka atomu nazywana jest powłoką walencyjną, a zlokalizowane na niej elektrony uczestniczą w tworzeniu wiązań chemicznych (kowalencyjnych, jonowych itp.).
Budowa układu okresowego
Wracając do wyglądu samego układu okresowego, można w nim wyróżnić 7 okresów (wierszy) oraz 18 grup (kolumn). Długość każdego z okresów jest uzależniona od konfiguracji elektronowej atomów, a dokładniej od liczny elektronów, jaką może pomieścić powłoka walencyjna. W skrócie: pierwiastki leżące w jednym okresie posiadają tyle samo powłok elektronowych, natomiast te znajdujące się w jednej grupie mają taką samą liczbę elektronów walencyjnych.
Grupy układu okresowego dzielone są dodatkowo na grupy główne (1,2 13-18) oraz poboczne (3-12). Podział oparty jest na rodzajach orbitali, na jakich rozmieszczone są elektrony walencyjne. Elektrony walencyjne pierwiastków grup głównych znajdują się na podpowłokach s i p, pierwiastków grup pobocznych na podpowłokach s i d, natomiast lantanowców i aktynowców na podpowłokach s, d i f. Z tego też względu poza wyróżnieniem dwóch rodzajów grup, układ okresowy został podzielony na bloki s (grupy 1 i 2), p (grupy 13-18), d (grupy 3-12) oraz f (lantanowce i aktynowce).
Tak jak już wspomniano liczba i rozmieszczenie elektronów, szczególnie walencyjnych, ma decydujący wpływ na właściwości pierwiastków i poza wzrastającą liczbą atomową, można zauważyć szereg innych cech „uporządkowanych” w układzie okresowym, co przedstawia uproszczony schemat:
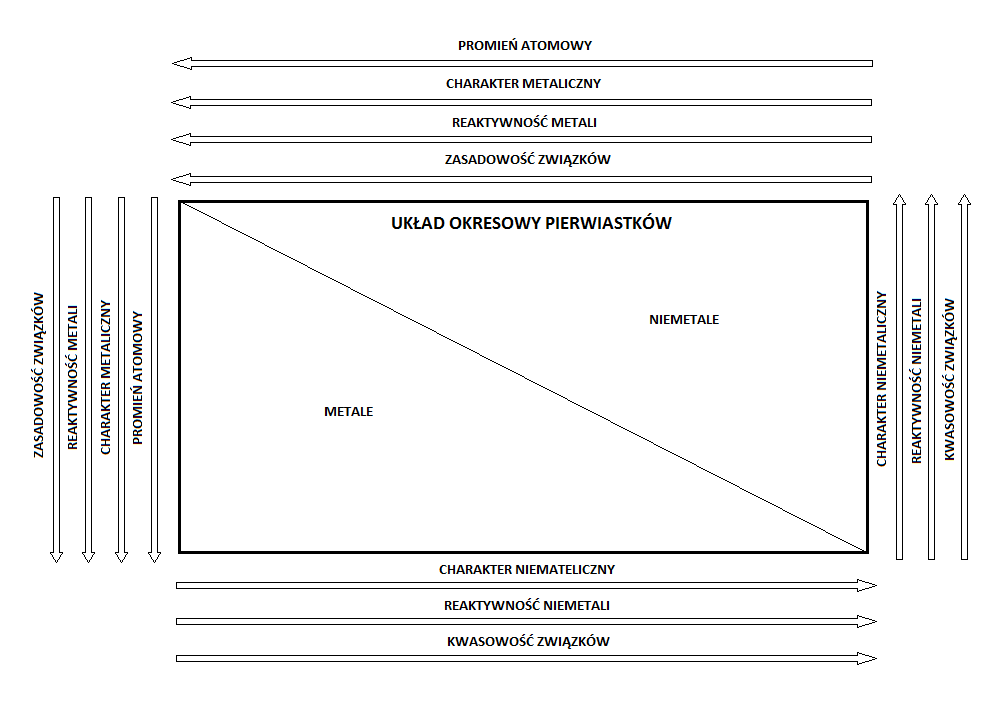
Zasady tworzenia układu okresowego Wasze opinie