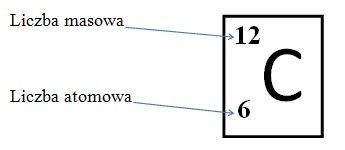
Każdy pierwiastek w układzie okresowym opisany jest dwoma liczbami. Liczby te charakteryzują skład jego jądra atomowego, są to: liczba masowa A oraz liczba atomowa Z.
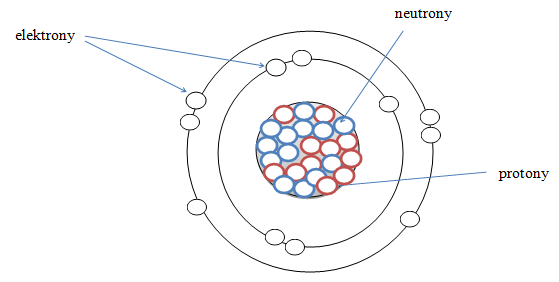
W budowie atomu można wyróznić takie cząstki elementarne jak: protony i neutrony (to właśnie z nich zbudowane jest jądro) oraz elektrony rozmieszczone wokół jądra.
Każdy ze 118 pierwiastków znajdujących się w układzie okresowym posiada swoją charakterystyczną liczbę od 1 (dla wodoru) do 118 (dla najcięższego pierwiastka), która określa jego właściwości chemiczne i większość fizycznych. Liczba ta nazywana jest liczbą atomową.
Liczba atomowa Z jest to liczba, która określa położenie w układzie okresowym danego pierwiastka i równa jest ona liczbie protonów w jądrze atomowym. Na przykładzie węgla można stwierdzić, że skoro jego liczba atomowa równa się 6 to oznacza to, że posiada on w swoim jądrze 6 protonów. W atomie liczba protonów czyli cząstek o ładunku dodatnim jest równa liczbie elektronów – cząstek o ładunku ujemnym, a zatem dzięki liczbie atomowej można również poznać liczbę elektronów krążących wokół jądra na powłokach elektronowych. Wracając do węgla stwierdzamy, że posiada on 6 protonów oraz 6 elektronów.
Liczba masowa A określa liczbę nukleonów czyli sumę protonów i neutronów w jądrze. Neurtony są cząstkami elektrycznie obojętnymi. Zauważmy, że znając liczbę atomową i masową pierwiastka łatwo możemy obliczyć liczbę neutronów. Przykład:
liczba atomowa węgla = 6
liczba masowa węgla = 12
liczba neutronów = liczba masowa – liczba atomowa = 12 – 6 = 6, a zatem węgiel w swoim jądrze atomowym posiada 6 neutronów.
Odmiany (nazywane izotopami) tego samego pierwiastka chemicznego różnią się liczbą masową.
Liczba masowa i atomowa Wasze opinie
wszystko zostało idealnie wyjaśnione, lecz czcionka jest troszeczkę za mała