Alkohole to grupa organicznych związków chemicznych, które posiadają przynajmniej jedną grupę hydroksylową (-OH) połączoną z atomem węgla w hybrydyzacji sp3. Najprostszymi i najczęściej wykorzystywanymi w życiu codziennym są alkohole monohydroksylowe o ogólnym wzorze sumarycznym CnH2n+1OH (np. metanol, etanol, propanol).
Dzięki obecności atomu tlenu cząsteczki alkoholi tworzą między sobą wiązania wodorowe (asocjują ze sobą), co zwiększa ich temperaturę wrzenia oraz topnienia i zmniejsza lotność. Niższe alkohole mają charakter polarny i dobrze mieszają się z wodą, a wraz ze wzrostem długości łańcucha alkohole stają się coraz bardziej hydrofobowe.
Ze względu na rzędowość atomu węgla, z jakim połączona jest grupa hydroksylowa, wyróżnia się alkohole I-, II- lub III-rzędowe (oraz metanol jako 0-rzędowy):

Przykłady alkoholi odpowiednio 0-, I-, II- i III-rzędowych.
Alkohole otrzymuje się na drodze hydratacji alkenów w środowisku kwaśnym, redukcji kwasów karboksylowych, aldehydów, ketonów, estrów, reakcji Grignarda lub hydrolizy halogenków alkilowych.
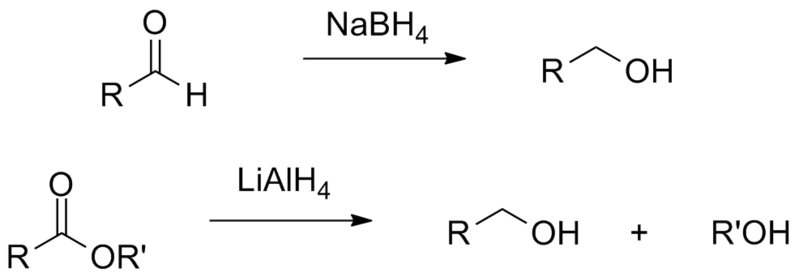
Reakcje redukcji aldehydu i ketonu do alkoholi.
Alkohole mają bardzo słabe właściwości kwasowe (słabsze od wody), ale reagują z silnymi zasadami (metalami aktywnymi), tworząc alkoholany:
2 CH3OH + 2 Na → 2 CH3ONa + H2
Przez obecność wolnej pary elektronowej na atomie tlenu alkohole wykazują właściwości zasadowe. Reagują z kwasami organicznymi i nieorganicznymi, dając estry (proces estryfikacji). Kwasami nieorganicznymi, które łatwo reagują z alkoholami, są: kwas azotowy (III), azotowy (V) oraz borowy. Natomiast kwasy: fosforowy (III), fosforowy (V), węglowy, krzemianowy czy siarkowy (VI) nie reagują bezpośrednio z alkoholami i do uzyskania ich estrów konieczne jest przeprowadzenie reakcji z ich chlorkami.
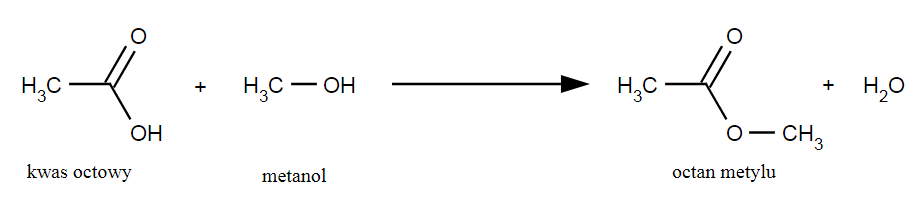
Reakcja estryfikacji.
Alkohole ulegają dehydratacji tj. odszczepienia cząsteczki wody. W jej wyniku powstają alkeny:
R-CH2-CH2-OH + H+ → R-CH=CH2 + H3O+
Poza eliminacją grupa hydroksylowa może uleć podstawieniu (wymianie) np. na atom fluorowca. Podstawienie ma charakter nuklefilowy.
Co więcej, alkohole można utleniać do aldehydów (alkohole I-rzędowe), ketonów (alkohole II-drugorzędowe) lub kwasów karboksylowych. Alkohole III-rzędowe nie ulegają utlenieniu. Czynnikami utleniającymi, działającymi na alkohole są: KMnO4, MnO2, K2Cr2O7, CrO3, HIO4.
Największe zastosowanie w gospodarce mają dwa alkohole: metanol i etanol. Metanol jest dobrym rozpuszczalnikiem i jest stosowany w m.in. przemyśle chemicznym i farmaceutycznym. Etanol ma szerokie zastosowanie w przemyśle spożywczym i farmaceutycznym.
Nazwy alkoholi tworzone są przez dodanie końcówki –ol do nazwy węglowodoru o szkielecie węglowym identycznym do omawianego alkoholu. Przed końcówką –ol konieczne jest dodanie lokanta grupy hydroksylowej.
Alkohole Wasze opinie