Z definicji entalpią reakcji (ΔH) bądź też zmianą entalpii reakcji nazywa się ciepło pochłaniane lub wydzielane przez reagujące substancje, zmierzone pod stałym ciśnieniem. Zmiana entalpii może być ujemna lub dodatnia:
- ΔH < 0, w przypadku, kiedy układ traci ciepło, tzn. reakcja jest egzotermiczna,
- ΔH > 0, w przypadku, kiedy układ pobiera ciepło z otoczenia, tzn. reakcja endotermiczna.
Warto w tym miejscu zastanowić się nad znaczeniem słów: układ i otocznie. Układem najczęściej nazywa się wszystkie substancje biorące udział w reakcji. Jest to zatem zespół ciał poddanych obserwacji. Otoczeniem zaś nazywa się wszystko to, co znajduje się poza układem. Występują trzy rodzaje układów:
- układ otwarty czyli taki, w którym pomiędzy układem a otoczeniem występuje wymiana masy i energii
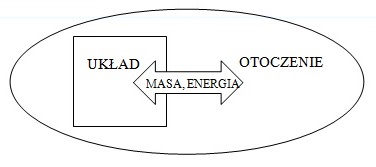
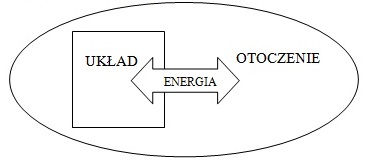
- układ zamknięty czyli taki, w którym pomiędzy układem a otoczeniem występuje wymiana energii, jednak nie występuje wymiana masy
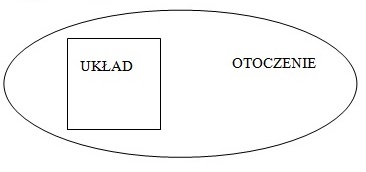
- układ izolowany czyli taki, w którym pomiędzy układem a otoczeniem nie występuje wymiana ani masy ani energii
Jednostką zmiany entalpii reakcji jest kilodżul na mol (kJ/mol). Jest to wartość ciepła wymienianego między reagentami a otoczeniem podawana w odniesieniu do 1 mola któregoś z reagentów. Obliczenia związane z ze zmianą entalpii reakcji zazwyczaj wykonuję się stosując proporcje. Wyniki podajemy jako wartości dodatnie bądź ujemne, w zależności od tego, czy reakcja przebiega z wydzieleniem czy pochłanianiem ciepła z otoczenia. Ilość ciepła wydzielonego lub pochłoniętego zależy od tego w jakich stanach skupienia występują reagenty, dlatego zawsze przy wzorach związków należy zapisać odpowiednie indeksy:
- (s) – ciała stałe
- (c) – ciecze
- (g) – gazy
Ilość ciepła wymienianego w reakcji można zaznaczać w równaniu reakcji, np.:
\(N_{2(g)} + 3 H_{2(g)} \rightarrow 2 NH_{3(g)} + 91,88 \: kJ\)
Zapis ten oznacza, że w reakcji 1 mola azotu z 3 molami wodoru powstają 2 mole amoniaku oraz wydzielane jest 91,88 kJ ciepła.
Entalpia reakcji Wasze opinie