Kwas octowy jest cieczą o ostrej woni i kwaśnym smaku. Mała lotność kwasu octowego wynika ze zdolności do tworzenia wiązań wodorowych między cząsteczkami kwasu, jego temperatura wrzenia jest wyższa od temperatury wrzenia wody. Jest on kwasem bardzo dobrze rozpuszczającym się w wodzie z wydzieleniem ciepła. Rozpuszczaniu kwasu w wodzie towarzyszy kontrakcja (zmniejszanie się) objętości.
Wzór sumaryczny
CH3COOH lub C2H4O2
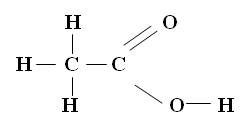
Wzór strukturalny kwasu etanowego
Właściwości
Masa cząsteczkowa – 60,06 g
Temperatura topnienia - 17°C
Temperatura wrzenia – 116 - 118°C
Temperatura zapłonu - 39°C
Prężność par – 15,4 hPa w 20°C
Względna gęstość oparów – 2,07
Gęstość względna – 1,05 g/cm3 (w 20°C)
Rozpuszczalność w wodzie – 1000g/l w 25°C
Rozpuszczalność w innych substancjach: miesza się z etanolem, gliceryną i eterem etylowym; jest nierozpuszczalny w disiarczku węgla
Temperatura samozapłonu - 485°C
Współczynnik załamania – 1,37 w 20°C
Kwas octowy jak sama nazwa wskazuje, wykazuje właściwości kwasowe. Papierek uniwersalny barwi się w jego roztworze na czerwono, a oranż metylowy wkroplony do roztworu kwasu octowego zmienia zabarwienie z pomarańczowego na czerwone. Zdolność do zmiany odczynu wynika z obecności silnie spolaryzowanego wiązania O – H w cząsteczce kwasu. Wiązanie to łatwo ulega rozerwaniu, w roztworze pojawiają się wtedy jony wodorowe, które są przyczyną zmiany zabarwienia wskaźników. Dysocjacja świadcząca o kwasowym charakterze kwasu octowego, zachodzi zgodnie z równaniem:
Kwas octowy reaguje z węglanami, przez co można stwierdzić, że jest on kwasem silniejszym od kwasu węglowego. Reakcja ta przebiega w sposób następujący:
Kwasy organiczne (w tym kwas octowy) są z reguły kwasami słabymi, jednak mimo to ich moc jest wystarczająca do przeprowadzenia reakcji z metalami, tlenkami metali i wodorotlenkami. W wyniku tych reakcji powstają sole zwane octanami. Przykłady takich reakcji:
- reakcja kwasu octowego z magnezem w wyniku której powstaje octan magnezu oraz wydziela się wodór:
- reakcja kwasu octowego z wodorotlenkiem sodu podczas której wodorotlenek zostaje zobojętniony i powstaje octan sodu oraz woda:
- reakcja kwasu octowego z tlenkiem miedzi (II), w której po ogrzaniu tworzy się niebieski roztwór octanu miedzi (II):
W związku z tym, że kwas octowy jest słabym kwasem, roztwory jego soli mają odczyn zasadowy. Sole te ulegają hydrolizie zgodnie z równaniem:
Otrzymywanie kwasu octowego
Reakcja ta jest bardzo dobrze znana w życiu codziennym, ponieważ odpowiada między innymi za kwaśnienie wina, a celowo stosowana jest do produkcji octu winnego.
Zastosowanie
Kwas octowy w przemyśle chemicznym służy do produkcji tworzyw sztucznych, rozpuszczalników oraz wielu związków będących półproduktami do syntezy bardziej złożonych substancji, takich jak leki czy środki ochrony roślin. Kwas octowy jest stosowany do otrzymywania bezwodnika kwasu octowego, acetocelulozy i monomeru octanu winylu, estrów kwasu octowego oraz kwasu chlorooctowego. Używa się go również do produkcji mas plastycznych, insektycydów, fotochemikaliów, do druku tkanin oraz jako naturalnego koagulatora lateksu. Najbardziej znane jednak zastosowanie kwasu octowego to jego 6- lub 10 – procentowy roztwór wodny, noszący nazwę octu i stosowany w życiu codziennym jako przyprawa.
Kwas etanowy (octowy) Wasze opinie