W życiu codziennym do określenia masy najczęściej posługujemy się jednostką, jaką stanowi kilogram. Wiadome jest jednak, że jednostkę można odpowiednio dopasować, na przykład masę telefonu komórkowego podamy w gramach, masę walizki w kilogramach zaś masę samolotu w tonach. Do określenia masy atomu bądź cząsteczki nawet miligramy stanowią zdecydowanie zbyt dużą jednostkę. Dlatego też wprowadzono atomową jednostkę masy tzw. unit. Tak jak można określić, że 1 gram stanowi 1/1000 kilograma tak unit definiowany jest jako 1/12 masy atomu węgla 12C.
1 u = 1/12 masy atomu węgla 12C ≈ 1,66 · 10-27 kg, czyli masa pojedynczego atomu węgla 12C podzielona przez 12 daje masę wzorca atomowej jednostki masy i w przybliżeniu wynosi ona 1,66 · 10-27 kg.
Z definicji wynika, że masa atomowa jest to masa pojedynczego atomu wyrażona w unitach. Określa ona zatem ile razy masa danego atomu jest większa od 1/12 masy atomu węgla 12C. Przykład:
Masa atomowa helu wynosi 4,0026 u. Obliczmy zatem ile razy hel jest lżejszy od atomu węgla?
Skoro 1 unit równa się 1/12 masy atomu węgla zatem pierwiastek mający masę atomową 1u byłby 12 razy lżejszy od atomu węgla. Wynika z tego również, że masa atomowa węgla równa się 12 u, a więc hel mając masę atomową 4,0026 u jest ok. 3 razy lżejszy od węgla (12/4,0026).
Masę atomową odczytuje się z układu okresowego pierwiastków, zazwyczaj jest ona zaokrąglana do najbliższych liczb całkowitych, zatem masa atomowa sodu wynosi 23 u.
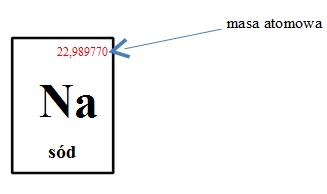
Należy pamiętać, że masa atomowa danego pierwiastka podana w układzie okresowym jest średnią masą atomową uwzględniającą różne odmiany izotopowe tego samego pierwiastka.
Znając masę poszczególnych atomów można obliczyć masę cząsteczki. Jako przykład może posłużyć cząsteczka wody H2O. W jej skład wchodzą dwa atomy wodoru oraz jeden atom tlenu. Z układu okresowego odczytujemy masy atomowe tych pierwiastków:
masa atomowa tlenu = 16 u
masa atomowa wodoru = 1 u
M cząsteczki H2O = masa atomowa tlenu + 2 · masa atomowa wodoru = 16 u + 2 · 1u = 18 u
Korzystając z powyższego przykładu można zdefiniować pojęcie masy cząsteczkowej, a zatem:
Masa cząsteczkowa jest sumą mas atomów wchodzących w skład cząsteczki wyrażoną w unitach.
Policzmy zatem masę cząsteczkową azotanu (V) magnezu Mg(NO3)2:
masa atomowa magnezu = 24 u
masa atomowa azotu = 14 u
masa atomowa tlenu = 16 u
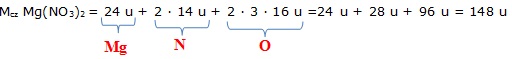
Masa cząsteczkowa azotanu (V) magnezu wynosi 148 u.
Masa atomowa i cząsteczkowa Wasze opinie
Super materiał. BARDZO FAJNIE OPISANE.