Aminokwasy (inaczej kwasy aminowe, skrót AA) to grupa organicznych związków chemicznych, posiadająca równocześnie grupę karboksylową (-COOH, lub inną kwasową np. sulfonową –SO3H) oraz zasadową grupę aminową (-NH3). Z tego względu w cząsteczkach aminokwasów dochodzi do wewnętrznej reakcji kwas-zasada i związki te występują głównie w formie jonów obojnaczych (soli wewnętrznych). pH, przy którym wszystkie cząsteczki aminokwasu występują w postaci jonu obojnaczego, nazywane jest punktem izoelektrycznym.

by DMacks; CC BY-SA 3.0, (https://commons.wikimedia.org/w/index.php?curid=1579018).
Właściwościami aminokwasy przypominają sole: mają budowę krystaliczną, są rozpuszczalne w wodzie, mają duże momenty dipolowe oraz wysokie temperatury topnienia.
Aminokwasy mogą zawierać 1°, 2°, 3° lub 4° grupę aminową – ostatnia grupa określana jest betainami.
Budowa cząsteczki aminokwasu jest tetraedryczna i w jej centrum znajduje się asymetryczny atom węgla – aminokwasy są więc związkami czynnymi optycznie. Występują w dwóch formach enancjomerycznych – D i L, przy czym w budowie białek obecna jest wyłącznie forma L.
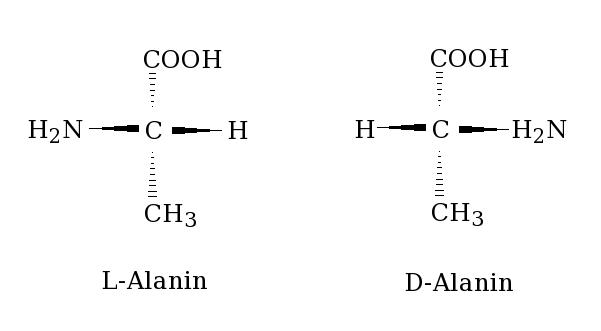
by De I, Csatazs, CC BY-SA 3.0, (https://commons.wikimedia.org/w/index.php?curid=2525213)
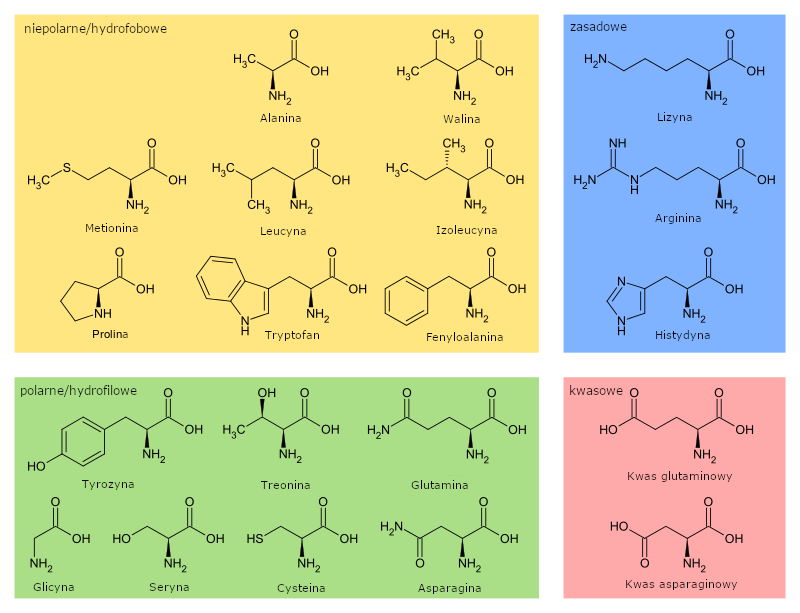
Aminokwasy można podzielić na naturalne oraz syntetyczne. Wśród naturalnych wyróżnia się aminokwasy oraz niebiałkowe (np. GABA – kwas γ-aminomasłowy, neuroprzekaźnik). Białkowe aminokwasy to te budujące peptydy oraz białka, jest ich łączne 20. Część z nich jest syntetyzowana w organizmie człowieka (endogenne), natomiast część musi być przyswajana wraz z pokarmem (egzogenne). Wszystkie aminokwasy białkowe są α-aminokwasami – grupę karboksylową i aminową dzieli jeden atom węgla.
Aminokwasami białkowymi są:
| ENDOGENNE | EGZOGENNE | ||
| Nazwa aminokwasu | Symbol aminokwasu | Nazwa aminokwasu | Symbol aminokwasu |
| Alanina | Ala | Arginina | Arg |
| Asparagina | Asn | Fenyloalanina | Phe |
| Cysteina | Cys | Histydyna | His |
| Glicyna | Gly | Izoleucyna | Ile |
| Glutamina | Gln | Leucyna | Leu |
| Kwas asparaginowy | Asp | Lizyna | Lys |
| Kwas glutaminowy | Glu | Metionina | Met |
| Prolina | Pro | Treonina | Thr |
| Seryna | Ser | Tryptofan | Trp |
| Tyrozyna | Tyr | Walina | Val |
Histydyna oraz arginina, pomimo zaliczania ich do aminokwasów egzogennych są wytwarzane w organizmie człowieka, jednak w niedostatecznej ilości (głównie u dzieci), dlatego konieczne jest również ich przyswajanie z zewnątrz.
Do aminokwasów białkowych bywają zaliczane również: selenocysteina i pirolizyna, ale występują one jedynie w białkach prokatiotów.
Ze względu na właściwości chemiczne aminokwasy można podzielić na następujące grupy:
Aminokwasy mogą łączyć się ze sobą, tworząc wiązanie peptydowe (pomiędzy grupą aminową jednego a karboksylową drugiego aminokwasu). Prowadzi to do powstania peptydów oraz białek.
Wiązanie peptydowe
Wiązanie peptydowe ma charakter kowalencyjny, a atomy je tworzące leżą w jednej płaszczyźnie – niemożliwa jest rotacja wokół wiązania C-N. Możliwy jest natomiast obrót wiązań Cα-N i Cα-C, którego kąt torsyjny wpływa na konfigurację przestrzenną łańcucha polipeptydu.
Peptydy to związki organiczne zbudowane z reszt aminokwasowych połączonych wiązaniami peptydowymi. Peptydy zbudowane z do 10 reszt aminokwasowych nazwane są oligopeptydami, a dłuższe to polipeptydy lub białka.
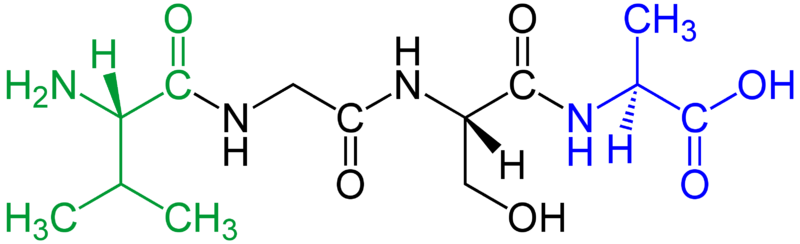
Przykład tripeptydu
Różnica pomiędzy polipeptydami a białkami (poza wielkością masy cząsteczkowej) ma wymiar funkcjonalny – polipeptydem jest dowolny łańcuch ponad 10 reszt aminokwasowych, natomiast białkiem jest łańcuch polipeptydowy, który po uzyskaniu odpowiedniej struktury przestrzennej zyskał funkcjonalną czynność biologiczną. Peptydy powstają na drodze translacji.
Białka (inaczej proteiny) to wielkocząsteczkowe, polimery organiczne (mogą osiągać masy cząsteczkowe do kilku mln Daltonów). Są głównym budulcem wszystkich organizmów żywych i pełnią szereg kluczowych ról w funkcjonowaniu metabolizmu. Syntetyzowane są na rybosomach podczas procesu translacji informacji RNA.
Budowa przestrzenna białka jest na tyle złożona, że podzielono ją na cztery poziomy uorganizowania:
– struktura pierwszorzędowa – to sekwencja reszt aminokwasowych w łańcuchu,
– struktura drugorzędowa – to przestrzenne ułożenie się odcinków łańcucha polipeptydowego (wyróżnia się tu takie struktury jak: α-helisa, β-kartka, β-zakręt itp.)
– struktura trzeciorzędowa – to wzajemne ułożenie struktur drugorzędowych łańcucha polipeptydowego,
– struktura czwartorzędowa – to wzajemne ułożenie się osobnych łańcuchów (domen) polipeptydowych i innych elementów wchodzących w skład białka np. reszt cukrowych, lipidowych, jonów metali.
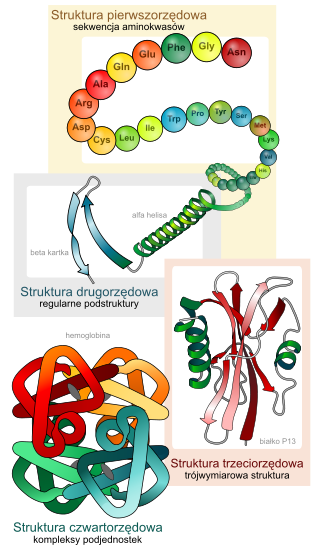
Struktura pierwszorzędowa jest związana wiązaniami chemicznymi (peptydowym), natomiast wyższe poziomy organizacji funkcjonują dzięki oddziaływaniom międzycząsteczkowym – sile Van Der Waalsa, wiązaniom wodorowym czy mostkom siarczkowym.
Białka są olbrzymią grupą związków, także podzielono je na szereg podgrup. Głównym podziałem opartym na budowie i składzie białek jest klasyfikacja na białka proste i złożone. Wśród białek prostych wyróżnia się:
– albuminy
– globuliny
– gluteliny
– histony
– prolaminy
– protaminy
– skleroproteiny
Do białek złożonych, w których budowie poza częścią białkową można wyróżnić inne ligandy, należą:
– chromoproteiny
– fosfoproteiny
– glikoproteiny
– lipoproteiny
– metaloproteiny
– nukleoproteiny
Pod kątem żywieniowym białka można podzielić na pełnowartościowe i niepełnowartościowe. Ma to związek ze składem aminokwasowym białek i ich użyteczności do syntezy protein własnych organizmu. Białka pełnowartościowe składem są najbardziej zbliżone do białek dane organizmu.
Białka są związkami wrażliwymi na szereg czynników. Większość z nich ulega denaturacji w wysokich temperaturach. Sam proces denaturacji polega na nieodwracalnym zniszczeniu struktury trzecio- i czwartorzędowej białka, przez co traci ono swoje właściwości biologiczne. Poza wysoką temperaturą proteiny denaturują w obecności metali ciężkich, mocnych zasad i kwasów, promieniowania jonizującego, niskocząsteczkowych alkoholi i aldehydów.
Większość białek (poza białkami fibrylarnymi) rozpuszczają się w wodzie. Mają zdolność do hydratowania (przyłączania) cząsteczek wody w swoją strukturę – w taki przypadku cząsteczki wody w pewien sposób stabilizują strukturę przestrzenną białka i zapewniają jej aktywność biologiczną. Niektóre proteiny mogą zostać rozpuszczone również w rozcieńczonych roztworach kwasów lub zasad albo też w rozpuszczalnikach organicznych.
Ciekawym zjawiskiem jest proces wysalania białek, który polega na wypadaniu białek z roztworu wodnego ze względu na zbyt duże stężenie soli nieorganicznych, które niszczą otoczkę solwatacyjną protein. Wywołuje to agregowanie się pojedynczych cząsteczek białka w większe konglomeraty – makroskopowo widoczne jest to jako wytworzenie żelu.
Tak jak budujące je aminokwasy, białka mają charakter jonów obojnaczych i posiadają punkt izoelektryczny. Nadaje im to właściwości buforujące.
Białka są grupą związków posiadających prawdopodobnie najszerszy zakres właściwości i aktywności biologicznych. Białka pełnią rolę budulcową, enzymatyczną, receptorową, ruchową, magazynową, immunologiczną (przeciwciała), buforową, regulacyjną (hormony), spajającą komórki (kadheryny) czy transportową. Koordynują pracę całego organizmu.
Aminokwasy, peptydy, białka Wasze opinie