Aminy to organiczne związki chemiczne posiadające grupę aminową (−NH2,−NHR, −NR'R). Są pochodnymi amoniaku – atomy wodoru zostały zastąpione grupami węglowodorowymi. W zależności ile podstawników organicznych przyłączonych jest do atomu azotu, wyróżnia się trzy rzędowości amin: I-, II- i III-rzędowe, schematycznie przedstawione poniżej. Znane są również czwartorzędowe związki amoniowe R4N+ (kationy i sole).
a)  b)
b)  c)
c) 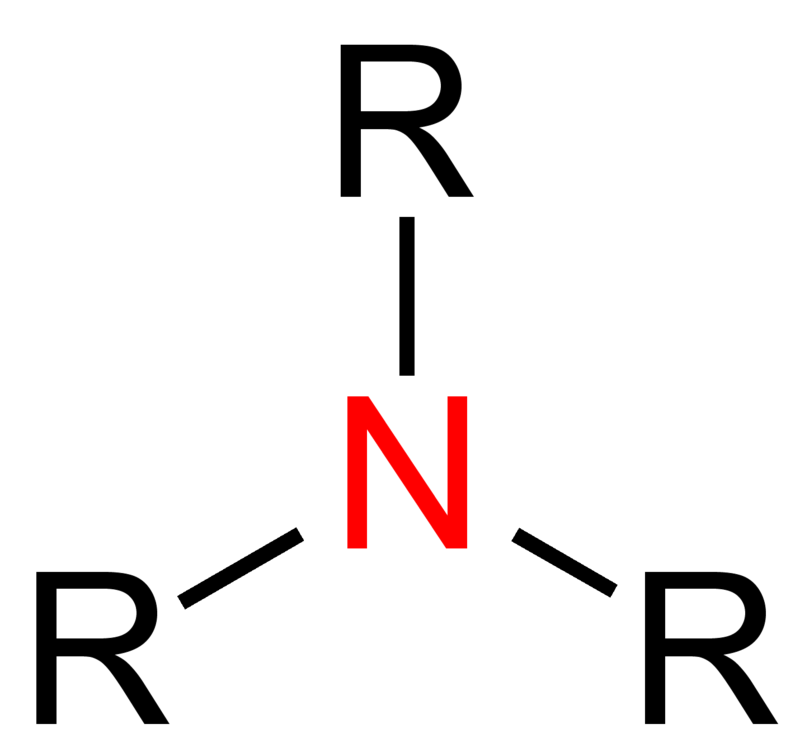 d)
d) 
Aminy a) I-rzędowe; b) II-rzędowe; c) III-rzędowe oraz d) IV-rzędowe związki amoniowe
W zależności od masy cząsteczkowej aminy są gazami (np. metyloamina, dimetyloamina), cieczami lub ciałami stałymi (anilina). Krótko łańcuchowe aminy alifatyczne są dobrze rozpuszczalne w wodzie i mają charakterystyczny rybi zapach. Podobnie jak alkohole, ze względu na obecność silnie elektroujemnego pierwiastka tj. azotu, cząsteczki amin mogą tworzyć wiązania wodorowe, co widocznie zmniejsza ich lotność.
Aminy otrzymuje się przez alkilowanie amoniaku halogenkami alkilowymi. Reakcja ta ma charakter substytucji nukleofilowej, w której czynnikiem nukleofilowym jest amoniak. Aminy są również produktami redukcji związków posiadających azot na wyższym niż –III stopniu utlenienie np.związków nitrozowych, nitrowych, azowych.

Reakcja alkilowana amoniaku
Redukcja azydku.
Aminy wykazują dużą reaktywność. Jest to spowodowane obecnością wolnej pary elektronowej na atomie azotu, która jest zazwyczaj centrum zachodzących reakcji. Z tego też względu aminy mają właściwości zasadowe. Aminy alifatyczne są silniejszymi zasadami, natomiast aromatyczne słabszymi od amoniaku. W reakcjach z kwasami nieorganicznymi, w zależności od rzędowości, dają sole mono-, di-, lub trialkiloamonowe. Istotne są reakcje amin z kwasem azotowym (III), ponieważ służą do identyfikacji rzędowości amin oraz rozróżnienia amin alifatycznych od aromatycznych:
– w przypadku I-rzędowych amin alifatycznych zaobserwuje się wydzielanie bezbarwnego gazu (azotu) w temp. poniżej 5°C,
– reakcja z I-rzędową aminą aromatyczną również skutkuje wydzieleniem się bezbarwnego gazu (azotu), jednak wymagana jest do tego wyższa temperatura,
– gdy w badanej próbce obecna jest amina II-rzędowa (aromatyczna lub alifatyczna) obserwuje się wydzielenie żółtej, oleistej cieczy,
– reakcja z aminami alifatycznymi III-rzędowymi nie daje widocznych efektów,
– w przypadku aromatycznych amin III-rzędowych roztwór zmienia barwę na pomarańczową.
W wyniku reakcji amin z kwasami organicznymi powstaje wiązanie peptydowe:
Aminy I-rzędowe reagują również aldehydami i ketonami, dając aldoiminy lub ketoiminy. Aminy mają słabe właściwości kwasowe, ale z silnymi zasadami (np. NaOH) tworzą sole – amidki. Atom azotu obecny w aminach jest na najniższym stopniu utlenienia, dlatego są one odporne na redukcję. Grupa aminowa poddana działaniu czynnika utleniającego (np. KMnO4) utlenia się do grupy nitrylowej (-NO2)
R-NH2 → R-NO2
W przypadku amin aromatycznych grupa aminowa silnie aktywuje pierścień aromatyczny i kieruje następne podstawniki do pozycji orto i para.
Nazwy amin I-rzędowych budowane są przez użycie rdzenia „amina” oraz wymienienie w kolejności alfabetycznej podstawników węglowodorowych. W przypadku obecności kilku grup aminowych zaznacza się to, dodając przedrostek di-, tri- przed rdzeniem „amina”. Dla amin II- i III-rzędowych wybiera się najważniejszą grupę węglowodorową, a nazwy pozostałych wymienia się jako podstawniki z przedrostkiem N, dla zaznaczenia, że łączą się z pozostałą częścią cząsteczki za pośrednictwem atomu azotu.
Aminy powszechnie występują w przyrodzie, gdzie biorą udział w obiegu azotu. Znalazły zastosowanie w przemyśle farmaceutycznym i chemicznym do produkcji farb, włókien, substancji powierzchniowo czynnych. Aminy aromatyczne są rakotwórcze.
Aminy Wasze opinie