Węglowodory aromatyczne (areny, skrót: WA) jest to grupa nienasyconych związków organicznych (ale znane są również nieorganiczne związki aromatyczne np. borazol), posiadająca specyficzne właściwości chemiczne, odbiegające od charakterystyki typowych związków nienasyconych. Ich odmienność wynika z wyjątkowej budowy układów aromatycznych, które spełniają poniższe warunki:
- są związkami pierścieniowymi,
- posiadają sprzężony układ wiązań podwójnych,
- sprzężenie elektronów wiązań π obejmuje cały pierścień cząsteczki,
- ich pierścienie mają konformację płaską (wszystkie węgle posiadają hybrydyzację sp2),
- liczba elektronów wiązań π musi spełniać regułę Hückela.
Zgodnie z regułą Hückela związki aromatyczne muszą posiadać 4n+2 elektronów tworzących wiązania π, gdzie n jest dowolną liczbą naturalną lub zerem. Zasada ta jest zawsze prawdziwa dla układów monocyklicznych, jednak w przypadku związków policyklicznych zdarzają się od niej odstępstwa.
Przykładami węglowodorów aromatycznych są: benzen, kation cyklopenylowy, kation cykloheptatrienylowy, anion cyklopentadienowy, azulen, naftalen, antracen, naftacen, piren.
a) b)
c)
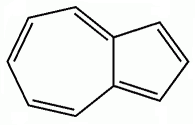
a) benzen; b) naftalen; c) azulen
Właściwości aromatyczne posiadają również związki heterocykliczne jak: furan, pirydyna, pirol:
a)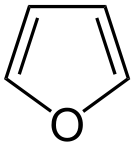 b)
b) 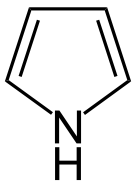
a) furan; b) pirol
Specyficzny cykliczny układ sprzężonych wiązań podwójnych, które obejmują całą cząsteczkę, zwiększa trwałość termodynamiczną związku. Węglowodory aromatyczne praktycznie nie ulegają reakcjom addycji, natomiast stosunkowo łatwo poddają się substytucji elektrofilowej.
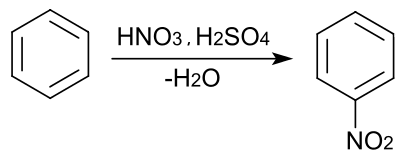
Substytucja elektrofilowa to rodzaj reakcji podstawienia gdzie związkiem przyłączającym się jest elektrofil – cząsteczka o dużym powinowactwie do elektronów (np. kation). Do typowych reakcji substytucji pierścienia aromatycznego należą:
-– nitrowanie – przyłączenie grupy nitrowej -NO2:
– halogenowanie – podstawienie atomu halogenku np -Cl, -Br
– sulfonowanie – podstawienie grupy sulfonowej -SO2OH
– alkilowanie – przyłączenie alkilowego łańcucha bocznego, możliwe jest tylko z wykorzystaniem choloro- lub bromopochodnych alifatycznych:
– acylowanie – wprowadzenie grupy acylowej -C(=O)R
Substytucja elektrofilowa przebiega dwuetapowo – w pierwszej kolejności do jednego z atomów węgla przyłącza się czynnik elektrofilowy, a sam węgiel przyjmuje hybrydyzację sp3, przez co układ traci aromatyczność. Drugim etapem jest odłączenie protonu i odzyskania struktury aromatycznej.
Związki posiadające podstawniki przy pierścieniu aromatycznym reagują inaczej niż związki niepodstawione. Przyczyną jest wpływ podstawników na szybkość i przebieg substytucji elektrofilowej. Jedne z nich jak np. grupa metylowa (-CH3) aktywują pierścień przez zwiększenie jego nukleofilowości, inne dezaktywują i utrudniają przebieg reakcji. W efekcie różne podstawniki wywierają skierowujący wpływ na kolejne podstawiane grupy. Poszczególne grupy podstawników zebrano w tabeli poniżej:
| Podstawniki | Wpływ na reaktywność pierścienia | Wpływ skierowujący |
| -O; -OH; -OR; -SH; -NR2; -NHR; -NH2; -OC(=O)R; -NHC(=O)R; -CH=CH2 | silna aktywacja pierścienia | orto, para |
| -C6H5; -CH3; -CR3 | słaba aktywacja pierścienia | orto, para |
| -F; -Cl; -Br; -I; -CH2Cl; -CH=CH-COOH; -CH=CH-NO2 | słaba dezaktywacja pierścienia | orto, para |
| -CCl3; -CF3; -CN; -NO2; -NH3+; -NR3+; -COOH; -SO3H; -C(=O)NH2; -C(=O)OR; -CHO; C(=O)R | silna dezaktywacja pierścienia | meta |
Poza reakcjami podstawienia elektrofilowego węglowodory aromatyczne ulegają również:
– redukcji (uwodornieniu),
– chlorowcowaniu z udziałem światła,
– ozonolizie,
– fluorowcowanie łańcucha bocznego,
– utlenianiu alifatycznego łańcucha bocznego (zawsze uzyskuje się kwas benzoesowy).
Węglowodory aromatyczne pozyskiwane są głównie z ropy naftowej. Znane są również metody syntezy jak timeryzaca acetylenu, której produktem jest benzen. Bifenyle uzyskuje się w reakcjach jodopochodnych benzenu z miedzią.
Węglowodory aromatyczne Wasze opinie
Ok.