Benzen jest przedstawicielem węglowodorów aromatycznych. Wzór sumaryczny C6H6, a zatem na jeden atom węgla przypada jeden atom wodoru. Jest związkiem cyklicznym, jego cząsteczka jest płaska, a odległości między węglami – identyczne. Wzór strukturalny:
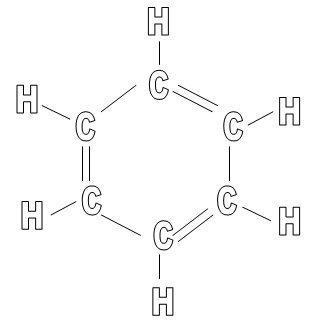
Oprócz powyższego wzoru strukturalnego można się spotkać jeszcze z innymi:
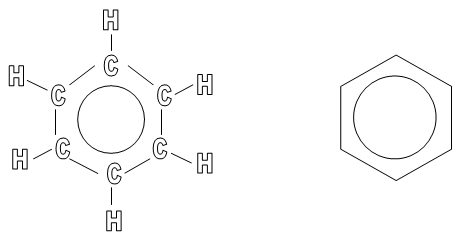

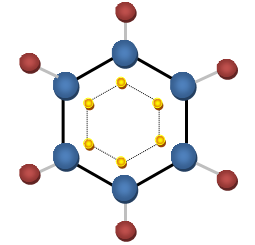
Taką cykliczną budowę nazywamy pierścieniem benzenowym, który jest wyjątkowo trwały. Każdy z sześciu atomów węgla ulega hybrydyzacji sp2, kąty pomiędzy wiązaniami wynoszą 120°. W wyniku nakładania się orbitali hybrydyzowanych sp2 atomów węgla, powstaje sześć wiązań C-C, zaś w wyniku nałożenia orbitali sp2 atomów węgla z orbitalami s atomu wodoru, powstaje sześć wiązań C-H. Wszystkie te wiązania są wiązaniami δ, czyli takimi, które powstają na skutek osiowego nałożenia się orbitali. Niezhybrydyzowane orbitale p sześciu atomów węgla tworzą orbital molekularny Π z sześcioma elektronami - sekstet elektronowy. Jest to rozmyte na całą cząsteczkę benzenu wiązanie nazywane zdelokalizowanym wiązaniem Π. Oznacza to, że nie łączy ono dwóch konkretnych atomów, ale pozostaje rozmyte na większy fragment cząsteczki, co przedstawia poniższy rysunek:

Właściwości fizyczne i chemiczne benzenu.
Benzen jest bezbarwną cieczą o charakterystycznym zapachu, toksyczną, o gęstości nieco mniejszej od gęstości wody, praktycznie nierozpuszczalną w wodzie. Służy jako rozpuszczalnik tłuszczów i mało polarnych związków organicznych. Temperatura wrzenia wynosi 80°C, zaś topnienia 5,5°C. To dzięki symetrycznej i płaskiej budowie cząsteczki, temperatura topnienia benzenu jest tak wysoka. Kryształ benzenu jest bardzo trudno stopić, ponieważ jego cząsteczki są dość ściśle upakowane i mogą ściśle ze sobą oddziaływać.
W powietrzu pary benzenu spalają się świecącym, silnie kopcącym płomieniem, w wyniku czego powstaje węgiel (a dokładniej sadza). Jest to spalanie niepełne, ponieważ zawartość tlenu w powietrzu jest zbyt niska, aby mógł ulec spalaniu pełnemu. Reakcja niepełnego spalania benzenu przebiega następująco:
\(2C_6H_6 + 3O_2 \rightarrow 12 C + 6 H_2O\)
Benzen bardzo łatwo ulega reakcjom substytucji, w których atom wodoru z pierścienia aromatycznego zostaje zastąpiony innym podstawnikiem w obecności odpowiedniego katalizatora. Najważniejsze z nich to:
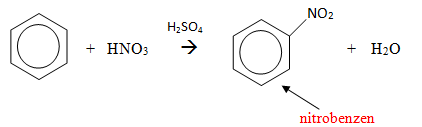
1) Reakcja nitrowania
Do jej przeprowadzenia stosuje się tak zwaną mieszaninę nitrującą, której składnikami są: kwas azotowy (V) i kwas siarkowy (VI). Elektrofilowym czynnikiem atakującym pierścień benzenowy jest kation nitroniowy NO2+. Kwas siarkowy (VI) pełni rolę katalizatora, ułatwiającego wytworzenie kationu nitroniowego z kwasu azotowego (V). W wyniku reakcji powstaje nitrobenzen czyli żółta ciecz o charakterystycznym migdałowym zapachu. Reakcję nitrowania benzenu nazywa się substytucją elektrofilową i przebiega ona następująco:

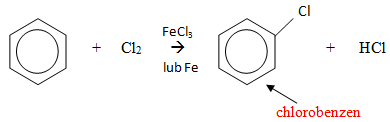
Polega ona na przyłączeniu do pierścienia benzenowego atomu chloru bądź bromu w miejsce atomu wodoru. Katalizatorami w tej reakcji są FeCl2 lub FeBr2, mogą być również opiłki żelaza bezpośrednio wrzucone do mieszaniny reakcyjnej. Schemat ogólny reakcji wygląda następująco:
Otrzymywanie benzenu
Benzen otrzymywany jest głównie z ropy naftowej podczas katalitycznego reformingu jak również w procesach dealkilacji i odwodornienia pochodnych benzenu. Kolejną metodą jest cyklizacja i aromatyzacja węglowodorów parafinowych.
Zastosowanie benzenu
Benzen w przemyśle chemicznym jest głównym produktem w syntezie organicznej. Służy do produkcji barwników, środków czyszczących, farmaceutyków oraz rozpuszczalników farb i lakierów. Stosowany jest do ekstrakcji tłuszczów oraz olejów roślinnych, a także stanowi wysokoenergetyczny składnik benzyny silnikowej.
Zagrożenia
Benzen jest substancją toksyczną i bardzo łatwo palną. Działa toksycznie w kontakcie ze skórą oraz przez drogi oddechowe, przez co może stworzyć poważne zagrożenie dla zdrowia. Możliwość zatruć występuje przede wszystkim w przemyśle gumowym, chemicznym, farmaceutycznym, farb i lakierów, a ostatnio w przemyśle tworzyw sztucznych. Pary benzenu tworzą mieszaniny wybuchowe z powietrzem, są cięższe od powietrza, gromadzą się przy powierzchni ziemi oraz w dolnych częściach pomieszczeń. Zbiorniki z benzenem narażone na działanie ognia lub wysokiej temperatury mogą eksplodować.
Benzen Wasze opinie