Kwasy karboksylowe to grupa związków organicznych, posiadająca grupę karboksylową (-COOH) z łatwo odchodzącym atomem wodoru (w formie kationu H+). Zgodnie z teorią Arrheniusa właściwość ta nadaje związkom charakter kwasowy:
RCOOH + H2O ⇄ RCOO− + H3O+
Łatwość oddysocjowania kation wodoru od cząsteczki kwasu wynika z możliwości delokalizacji ujemnego ładunku na sąsiadujące atomy tlenu.
Właściwości kwasów karboksylowych
Kwasy karboksylowe o łańcuchach zbudowanych z maksymalnie 10 atomów węgla w warunkach standardowych są dobrze rozpuszczającymi się w wodzie cieczami o drażniącym zapachu. Wraz ze wzrostem długości łańcucha rośnie hydrofobowość kwasów oraz ich gęstość i lotność – kwasy zawierające więcej niż 10 atomów węgla są ciałami stałymi.
W porównaniu do kwasów nieorganicznych kwasy organiczne, karboksylowe wykazują słabą kwasowość – ich stała dysocjacji wypada w zakresie 10-4 – 10-5. Reagują z wodorotlenkami dając sole organiczne. Moc kwasów karboksylowych wzrasta gdy w ich budowie obecne są podstawniki stabilizujące postać anionową np. atomy fluorowców.
Kwasy karboksylowe - otrzymywanie
Kwasy karboksylowe są otrzymywane przez utlenienie alkoholi lub aldehydów. Kwasy aromatyczne można uzyskać przez utlenienie łańcucha bocznego węglowodoru aromatycznego.
Charakterystyczne dla kwasów karboksylowych są reakcje substytucji nukleofilowej przy karboksylowym atomie węgla (tego, który wchodzi w skład grupy karboksylowej). Polegają one na podstawieniu grupy hydroksylowej inną np. –OR, -NH2, -Cl. Ich produktami są kolejno estry, amidy kwasowe oraz chlorki kwasowe a wyniku odwodnienia kwasów karboksylowych powstają bezwodniki kwasowe.

Reakcja kwasu octowego z trichlorkiem fosforu, w wyniku której powstaje chlorek octowy.
Reakcja odwodnienie kwasu octowego, która daje bezwodnik octowy.
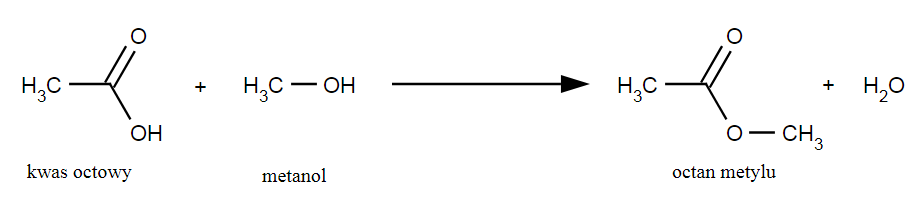
Reakcja estryfikacji.
Kwasy karboksylowe, u których zerwanie wiązania C-C jest relatywnie proste (np. α-dikarboksy kwasy lub α-ketokwasy) mogą również ulegać utlenieniu m.in. do dwutlenku węgla. W reakcji z nadtlenkiem wodoru powstają natomiast nadklasy, które same są dobrymi utleniaczami:
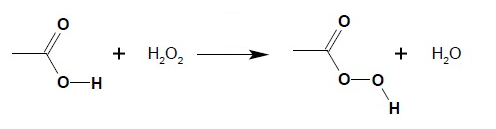
Kwasy organiczne mogą również ulegać redukcji do alkoholi I-rzędowych (w obecności LiAlH4 lub B2H6) czy dekarboksylacji (tj. eliminacji grupy CO2 z cząsteczki) oraz fluorowcowaniu w pozycji α.
Nazwy kwasów karboksylowych
Nazwy systematyczne kwasów karboksylowych pochodzą od nazw węglowodorów, od których pochodzą, jednakże bardziej powszechne jest stosowanie ich nazw zwyczajowych np.:
metan – kwas metanowy – kwas mrówkowy
etan – kwas etanowy – kwas octowy
propan – kwas propanowy – kwas propionowy
butan – kwas butanowy – kwas masłowy
benzen – kwas benzenokarboksylowy – kwas benzoesowy
Ciekawymi pochodnymi kwasów karboksylowych są hydroksykwasy, posiadające jako podstawnik grupę hydroksylową. Są rozpuszczającymi się w wodzie cieczami lub ciałami stałymi. Stosunkowo łatwo odszczepiają cząsteczkę wody, dając laktydy. Im bliżej grupa –OH jest położona grupy karboksylowej, tym kwas jest mocniejszy. Przykładowym hydroksykwasem jest kwas mlekowy:

Kwasy karboksylowe Wasze opinie