Metan jest to przedstawiciel alkanów, charakteryzujący się najprostszą budową cząsteczki.
Wzór sumaryczny
CH4
Wzór strukturalny
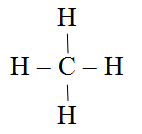
Wzór elektronowy
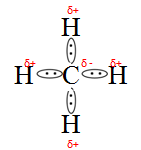
W cząsteczce metanu atom węgla połączony jest z atomem wodoru za pośrednictwem wiązania δ. Wiązanie to powstało w wyniku nałożenia się orbitalu sp3 atomu węgla na orbital s atomu wodoru. Doświadczalnie stwierdzono, że wszystkie wiązania C – H mają jednakową długość i energię. Okazuje się również, że cząsteczka metanu ma kształt czworościanu foremnego (tetraedru), w którego narożach znajdują się atomy wodoru, a w środku – atom węgla.
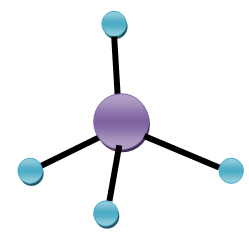
W cząsteczce metanu odległości od jądra atomu węgla do jądra każdego z atomów wodoru są takie same i wynoszą 109 pm (1 pm = 1 · 10-12 m), a kąty między nimi są równe 109°28’. Taki układ wiązań, jak w cząsteczce metanu, nosi nazwę układu tetraedrycznego, a atom węgla związany w ten sposób czterema innymi atomami – tetraedrycznego atomu węgla.
Właściwości
Stan skupienia w temp. 20°C: Gaz.
Barwa: Bezbarwny.
Zapach: Bezwonny.
Masa molowa: 16 g/mol
Temperatura topnienia: -182 °C
Temperatura wrzenia: -161 °C
Temperatura krytyczna: -82 °C
Zakres zapalności: 4.4 17 obj.% w powietrzu
Rozpuszczalność w wodzie: 26 mg/l
Temperatura samozapłonu: 595 °C
Metan jest głównym składnikiem gazu ziemnego. W połączeniu z powietrzem tworzy mieszaninę wybuchową. To właśnie metan odpowiedzialny jest za szereg wypadków w kopalniach. Całkowite spalanie metanu, w wyniku którego powstaje dwutlenek węgla i woda przedstawia poniższa reakcja:
\(CH_4 + 2 O_2 \rightarrow CO_2 + 2 H_2O + \text{energia}\)
Warto również zaznaczyć że podczas tej reakcji wydziela się duża ilość ciepła. W przypadku dostarczenia zbyt małej ilości tlenu następuje spalanie niepełne, co w konsekwencji prowadzi do powstanie tlenku węgla (II) czyli czadu i wody lub węgla i wody. Reakcje te przebiegają następująco:
\(2 CH_4 + 3 O_2 \rightarrow 2 CO + 4 H_2O\)
\(CH_4 + O_2 \rightarrow C + 2 H_2O\)
Metan, jako przedstawiciel węglowodorów, ulega również reakcji chlorowania. Reakcję tę w sposób ogólny można zapisać następująco:
\(CH_4 + Cl_2 \xrightarrow{swiatlo} CH_3Cl + HCl\)
Otrzymywanie
Jedną z metod otrzymywania metanu jest synteza z pierwiastków, która przebiega w ściśle określonych warunkach (temperatura 500°C):
\(C + 2 H_2 \rightarrow CH_4\)
Kolejnym metodą jest ogrzewanie mieszaniny octanu sodu z wodorotlenkiem sodu przebiegająca w podwyższonej temperaturze (dekarboksylacja):
\(CH_3COONa + NaOH \rightarrow CH_4 + Na_2CO_3\)
Metan otrzymywany jest również w reakcji węgliku glinu z kwasem np. solnym:
\(Al_4C_3 + 12 HCl \rightarrow 3 CH_4 + 4 AlCl_3\)
Zastosowanie
Metan ze względu na niską cenę oraz łatwość pozyskiwania ma wiele różnych zastosowań. Jest składnikiem gazu ziemnego stąd też stosowany jest jako paliwo. Używany jest w piecach gazowych, a także w kuchenkach gazowych jako mieszanina z azotem. W przemyśle chemicznym stosowany jest do produkcji między innymi wodoru, tlenku węgla, gazu węglowego, metanolu oraz nawozów sztucznych. W gospodarstwach domowych służy do ogrzewania budynków. Ma również zastosowanie w produkcji farb drukarskich oraz wyrobów gumowych. Istotne jest także zastosowanie metanu w energetyce, co jest ważne nie tylko dla gospodarki ale również korzystnie wpływa na ochronę środowiska oraz poprawę bezpieczeństwa energetycznego.
Metan Wasze opinie