Stan skupienia to forma, w jakiej może istnieć materia.
Rozróżnia się trzy podstawowe stany skupienia:
- stan gazowy - atomy i cząsteczki znajdują się w dużych odległościach od siebie, poruszają się swobodnie oraz zderzają się ze sobą i ściankami naczynia. Materia nie zachowuje ani kształtu, ani objętości.
- stan ciekły - atomy i cząsteczki leżą blisko siebie, przyciągają się i odpychają, ale mogą się swobodnie przemieszczać. Materia ma ustaloną objętość, ale nie ma ustalonego kształtu.
- stan stały - atomy i cząsteczki leżą blisko siebie i są ze sobą mocno związane, nie mogą się przemieszczać, ale mogą wykonywać ruchy drgające. Materia ma ustalony kształt i objętość.
Substancje w zależności od temperatury i ciśnienia otoczenia przechodzą z jednego stanu skupienia do drugiego.
Doskonałym przykładem jest woda, która poniżej temperatury zera stopni Celsjusza przechodzi w stan stały - lód, w granicach od zera do stu stopni jest ciekła, powyżej stu stopni staje się parą, czyli przechodzi w stan lotny. Zachodzi to w warunkach normalnych, w których ciśnienie równe jest P= 1013 hPa.
Poniższy wykres przedstawia zależność ciśnienia od temperatury w przejściach fazowych (zmianach stanów skupienia).
Strzałki oznaczają przemiany fazowe:
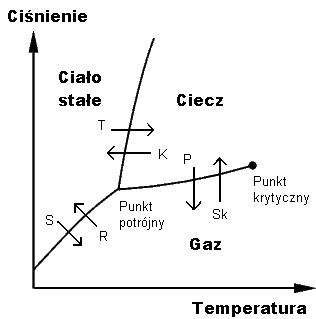
T - topnienie - przejście z fazy stałej do fazy ciekłej
K - krzepnięcie - przejście z fazy ciekłej do fazy stałej
P - parowanie - przejście z fazy ciekłej do fazy gazowej
Sk - Skraplanie - przejście z fazy gazowej do fazy ciekłej
S - Sublimacja - przejście z fazy stałej do fazy gazowej
R - Resublimacja - przejście z fazy gazowej do fazy stałej
Punkt potrójny - stan, w którym dana substancja może istnieć równocześnie w trzech stanach skupienia
Punkt krytyczny - punkt przejścia układu fizycznego w stan o odmiennych właściwościach, w którym nie można rozróżnić obu stanów
Stany skupienia ciał Wasze opinie