Glikol etylenowy jest alkoholem, który w swej cząsteczce zawiera dwie grupy hydroksylowe, stąd też jego nazwa systematyczna: 1,2 – etanodiol.
Wzór sumaryczny
C2H6O2 lub C2H4(OH)2
Wzór strukturalny
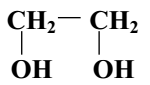
Właściwości
Masa cząsteczkowa: 62,07
Stan skupienia w temp. 20°C: ciecz
Temperatura topnienia: -13°C
Temperatura wrzenia: 197,6°C
Temperatura zapłonu:
- w zamkniętym tyglu: 111°C
- w otwartym tyglu: 115,5°C
Temperatura samozapłonu: 410°C
Stężenie stechiometryczne: 7,75% obj.
Gęstość w temp. 20°C: 1,113 g/cm3
Prężność par w temp. 20°C: 0,07 hPa
Stężenie pary nasyconej w temp. 20°C: 0,15 g/m3
Ciepło właściwe w temp. 20°C: 2,345 J/(g K)
Ciepło parowania w temp. wrzenia: 813,3 J/g
Ciepło spalania: -19,07 kJ/g
Glikol jest bezbarwną cieczą o dużej lepkości. Z wodą miesza się bez ograniczeń, co wynika z dużego udziału grup hydroksylowych w budowie cząsteczek glikolu. Rozpuszczalność w innych substancjach jest różna, np.: dobrze rozpuszcza się w alkoholach alifatycznych, aldehydach, ketonach i kwasie octowym; w benzenie, benzynie i olejach mineralnych rozpuszcza się trudno zaś w ogóle nie rozpuszcza się w czterochlorku węgla. Wysokie temperatury wrzenia – przy stosunkowo niewielkiej masie cząsteczkowej – wskazują na bardzo silną asocjację cząsteczek w fazie ciekłej w wyniku tworzenia wiązań wodorowych.
Otrzymywanie
Glikol etylenowy otrzymywany jest głównie z etylenu. Pierwszy etap polega na utlenieniu etylenu w obecności katalizatora do tlenku etylenu. Następnie powstały tlenek poddaje się hydrolizie w środowisku kwaśnym w celu otrzymania ostatecznego produkty czyli glikolu etylenowego. Reakcje to możemy przedstawić w sposób następujący:
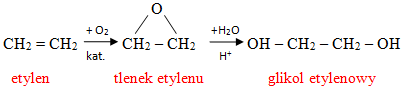
Glikol można również otrzymać z dichloroetanu w reakcji hydrolizy zasadowej 1,2 - dichloroetanu:
\(CH_2 = CH_2 + CH_2 \rightarrow Cl – CH_2 – CH_2 – Cl\)

Glikol można również otrzymać z dichloroetanu w reakcji hydrolizy zasadowej 1,2 - dichloroetanu:
\(CH_2 = CH_2 + CH_2 \rightarrow Cl – CH_2 – CH_2 – Cl\)
eten dichloroetan
\(Cl – CH_2 – CH_2 – Cl + 2 NaOH \rightarrow OH – CH_2 – CH_2 – OH + 2 NaCl\)
\(Cl – CH_2 – CH_2 – Cl + 2 NaOH \rightarrow OH – CH_2 – CH_2 – OH + 2 NaCl\)
dichloroetan glikol etylenowy
Zastosowanie
Głównym zastosowaniem glikolu jest produkcja włókien syntetycznych oraz żywic, które stosowane są do wyrobu laminatów i farb. Jest również składnikiem niezamarzających płynów do chłodnic samochodowych, np. płyn „borygo” jest ok. 50% wodnym roztworem glikolu z dodatkami antykorozyjnymi. Można go stosować w temperaturze do -35°C. Występuje również jako składnik kosmetyków i detergentów.
Szkodliwość
Zastosowanie
Głównym zastosowaniem glikolu jest produkcja włókien syntetycznych oraz żywic, które stosowane są do wyrobu laminatów i farb. Jest również składnikiem niezamarzających płynów do chłodnic samochodowych, np. płyn „borygo” jest ok. 50% wodnym roztworem glikolu z dodatkami antykorozyjnymi. Można go stosować w temperaturze do -35°C. Występuje również jako składnik kosmetyków i detergentów.
Szkodliwość
Glikol etylenowy jest substancją szkodliwą, depresyjnie działającą na ośrodkowy układ nerwowy. Działa drażniąco na błony śluzowe nosa i spojówki. Organizm wchłania go poprzez drogi oddechowe, skórę oraz z przewodu pokarmowego. Drogą pokarmową glikol początkowo powoduje objawy podobne do upojenia alkoholem, po czym (po kilku bądź kilkunastu godzinach) doprowadza do kwasicy metabolicznej. W przypadku podgrzewania glikolu powstająca para może prowadzić do utraty przytomności, natomiast w małych stężeniach powoduje podrażnienie nosa i gardła oraz bóle głowy. Warto zatem przy pracy z glikolem zachować szczególną ostrożność.
Glikol etylenowy (1,2 – etanodiol) Wasze opinie