Eten jest głównym przedstawicielem alkenów. Związek ten ma ogromne zastosowanie w przemyśle. Używa się go również do wielu syntez organicznych.
Wzór sumaryczny
C2H4
Wzór strukturalny
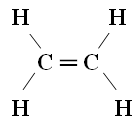
Właściwości
Postać fizyczna: Bezbarwny gaz
Masa molowa: 28 g/mol
Temperatura topnienia: -169 °C
Temperatura wrzenia: -103 °C
Granice palności: 2,4 %(V) - 32,6 %(V)
Rozpuszczalność w wodzie: 131 mg/l
Temperatura samozapłonu: 425 °C
Temperatura krytyczna: 9,5 °C
Eten jest związkiem o dużej reaktywności, czego dowodem jest fakt, że bardzo szybko odbarwia wodę bromową. Przyczyną dużej reaktywności etenu jest wiązanie podwójne C ═ C. Reakcja etylenu z bromem przebiega zgodnie z równaniem:
\(CH_2 ═ CH_2 + Br_2 \rightarrow Br – CH_2 – CH_2 – Br\)
W wyniku powyższej reakcji tworzy się związek nasycony – 1,2 – dibromoetan.
Eten jako najważniejszy z alkenów ulega także charakterystycznym dla nich reakcjom. Są to głównie reakcje addycji czyli przyłączenia takich związków jak wodór, chlorowodór, bromowodór, woda w obecności kwasów, oraz przedstawione wyżej fluorowce. Przykłady:
1) Reakcja etenu z wodorem w wyniku której powstaje etan:
\(CH_2 ═ CH_2 + H_2 \xrightarrow{kat} CH_3 – CH_3\)
2) Reakcja etenu z bromowodorem prowadząca do powstania bromoetanu:
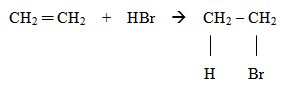
3) Reakcja etenu z wodą prowadząca do powstania alkoholu etylowego
\(CH_2 ═ CH_2 + H_2O \xrightarrow{H+} CH_3 – CH_2 – OH\)
Eten ulega również reakcji polimeryzacji czyli łączeniu się cząsteczek (monomerów) w długie łańcuchy zwane polimerami. Reakcja wymaga zwiększonego ciśnienia oraz obecności katalizatora. Proces ten zachodzi dzięki pękaniu wiązań π. Można go zapisać za pomocą następującego równania:
\(n CH_2 = CH_2 \xrightarrow[temperatura,cisnienie]{katalizator} -(CH_2-CH_2-)_n -\)
Produktem polimeryzacji etenu jest polietylen. Jest to przezroczysta substancja stosowana do produkcji opakowań, na przykład torebek śniadaniowych, plastikowych butelek, błon filmowych.
Zastosowanie
Eten przetwarza się bezpośrednio lub pośrednio w produkty polimeryzacyjne, znane pod nazwami PCV, polietylen, styropian. Produkty te zwane tworzywami sztucznymi mają wiele zastosowań, np. folie do pakowania. Eten jest również substratem do otrzymywania takich związków jak: kwas octowy, alkohol etylowy, glikol etylenowy, dichloroetan czy chlorek winylu. Bardzo istotną role eten odgrywa dla organizmów żywych. Stwierdzono, że w roślinach pełni rolę hormonu wzrostu. Jest związkiem odpowiedzialnym za kiełkowanie nasion, kwitnienie roślin, dojrzewanie owoców oraz usychanie płatków i liści. W gospodarstwach rolniczych stosowany jest w celu przyspieszenia procesu dojrzewania owoców oraz do regulacji wzrostu upraw.
n – liczba łączących się monomerów sięgająca kilkunastu tysięcy.
Produktem polimeryzacji etenu jest polietylen. Jest to przezroczysta substancja stosowana do produkcji opakowań, na przykład torebek śniadaniowych, plastikowych butelek, błon filmowych.
Zastosowanie
Eten przetwarza się bezpośrednio lub pośrednio w produkty polimeryzacyjne, znane pod nazwami PCV, polietylen, styropian. Produkty te zwane tworzywami sztucznymi mają wiele zastosowań, np. folie do pakowania. Eten jest również substratem do otrzymywania takich związków jak: kwas octowy, alkohol etylowy, glikol etylenowy, dichloroetan czy chlorek winylu. Bardzo istotną role eten odgrywa dla organizmów żywych. Stwierdzono, że w roślinach pełni rolę hormonu wzrostu. Jest związkiem odpowiedzialnym za kiełkowanie nasion, kwitnienie roślin, dojrzewanie owoców oraz usychanie płatków i liści. W gospodarstwach rolniczych stosowany jest w celu przyspieszenia procesu dojrzewania owoców oraz do regulacji wzrostu upraw.
Eten (etylen) Wasze opinie