1. Wzór sumaryczny


2. Wzór strukturalny
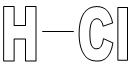
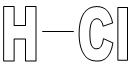
3. Właściwości fizyczne
Chlorowodór to związek powstający przez bezpośrednie połączenie chloru i wodoru. Jest to bezbarwny gaz o duszącym działaniu, nieprzewodzący prądu elektrycznego.
- Ciężar właściwy = 0,00164
- Gęstość względna = 18,23
- Ciężar cząsteczkowy = 36,47
- Temperatura krytyczna = +51,4°C
- Temperatura wrzenia = -84,9°C
- Temperatura topnienia = -118,4°C
- Rozpuszczalność k0 = 507
- Rozpuszczalność k20 = 442
4. Właściwości chemiczne
Wodne roztwory HCl w przeciwieństwie do czystego skroplonego chlorowodoru, doskonale przewodzą prąd elektryczny. Ponadto wodny roztwór chlorowodoru barwi papierek lakmusowy na czerwono, co potwierdza jego kwasowy charakter. Stężony roztwór kwasu chlorowodorowego jest silnie żrącą, bezbarwną cieczą, która niszczy tkaninę, papier i skórę. Maksymalne stężenie, jakie można uzyskać to 37%.
5. Otrzymywanie
W przemyśle bardzo czysty chlorowodór otrzymuje się syntetycznie z chloru i wodoru:\(Cl_2 + H_2 \rightarrow 2HCl\)
\(NaCl + H_2SO_4 \rightarrow NaHSO_4 + HCl (↑)\)
\(NaCl + NaHSO_4 \rightarrow Na_2SO_4 + HCl (↑)\)
6. Zastosowanie
Kwas solny, czyli wodny roztwór gazowego chlorowodoru używany jest w przemyśle tekstylnym, do fabrykacji barwników i środków leczniczych oraz do usuwania tlenków metali, np. z żelaza. Znajduje również zastosowanie w garbarstwie oraz cukrownictwie. Kwasu tego używa się również do produkcji glikozy i innych produktów ze skrobi. Czysty kwas chlorowodorowy jest jednym z najważniejszych odczynników laboratoryjnych.
Chlorowodór Wasze opinie