Kwasy siarkowe to grupa tlenowych kwasów nieorganicznych, różniących się stopniami utlenienia, budujących je atomów siarki. Siarka może występować na 8 różnych stopniach utlenienia: –II, –I, I, II, III, IV, V i VI.
Do kwasów siarkowych należą:
- kwas siarkowy (II) (kwas sulfoksylowy) – H2SO2
- kwas siarkowy (IV) (kwas siarkawy ) – H2SO3
- kwas siarkowy (VI) – H2SO4
- kwas nadtlenosiarkowy (kwas Caro) – H2SO5
- kwas nadtlenodisiarkowy – H2S2O8
- kwas tiosiarkowy (IV) (kwas tiosiarkawy ) – H2S2O2
- kwas tiosiarkowy (VI) – H2S2O3
- kwas ditionawy (kwas podsiarkawy) – H2S2O4
- kwas ditionowy (kwas posiarkowy) – H2S2O6
- kwas disiarkowy (IV) (kwas pirosiarkowy) – H2S2O5
- kwas siarkowy dymiący (oleum) – H2S2O7
- kwas sulfonowy – HSHO3
- kwas polisiarkowy (VI) - H2SO4•nSO3
- kwas politionowy – H2SxO6
- dihydroksydisulfan – H2S2O2
Do najbardziej popularnych należą – kwas siarkowy (IV), kwas siarkowy (VI) oraz kwas siarkowy (II).
Kwas siarkowy (IV) (kwas siarkawy, wzór sumaryczny – H2SO3) jest kwasem nietrwałym o słabej mocy, nieposiadającym właściwości utleniających. Ma postać bezbarwnej cieczy o duszącym zapachu siarki. Masa molowa tego kwasu wynosi 82,08 g/mol.
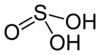
Siarka w kwasie siarkowym (IV) jest na IV stopniu utlenienia.
Stężenie nasyconego wodnego roztworu kwasu siarkowego (IV) wynosi 6%. Roztwór taki ma gęstość 1,03 g/cm3. Są w nim obecne jony: H3O+, HSO−3, S2O2−5, SO2− oraz hydraty o wzorze SO2*nH2O (kwas siarkowy (IV) jest niekiedy określany wodnym roztworem dwutlenku siarki). Cząsteczki H2SO3 nie zostały jak dotąd wykryte w roztworach wodnych kwasu (jedynie w stanie gazowym).
Kwas siarkowy (IV) tworzy z metalami sole – wodorosiarczany (IV) i siarczany (IV).
Kwas siarkawy ma właściwości bakterio- i grzybobójcze. Jest substancją trującą i silnie drażniącą. Może być stosowany jako wybielacz w przemyśle papierniczym czy włókienniczym. W syntezie laboratoryjnej wykorzystuje się go jako środek redukujący.
Kwas siarkowy (VI) (wzór sumaryczny – H2SO4) jest jednym z najmocniejszych kwasów (kwasy silniejsze od niego określane są jako superkwasy). Ma postać bezwonnej, bezbarwnej, oleistej cieczy (gęstość – 1,8302 g/cm3), bardzo higroskopijnej. Jego masa molowa wynosi 98,08 g/mol. Jest rozpuszczalny w wodzie, miesza się również z etanolem.
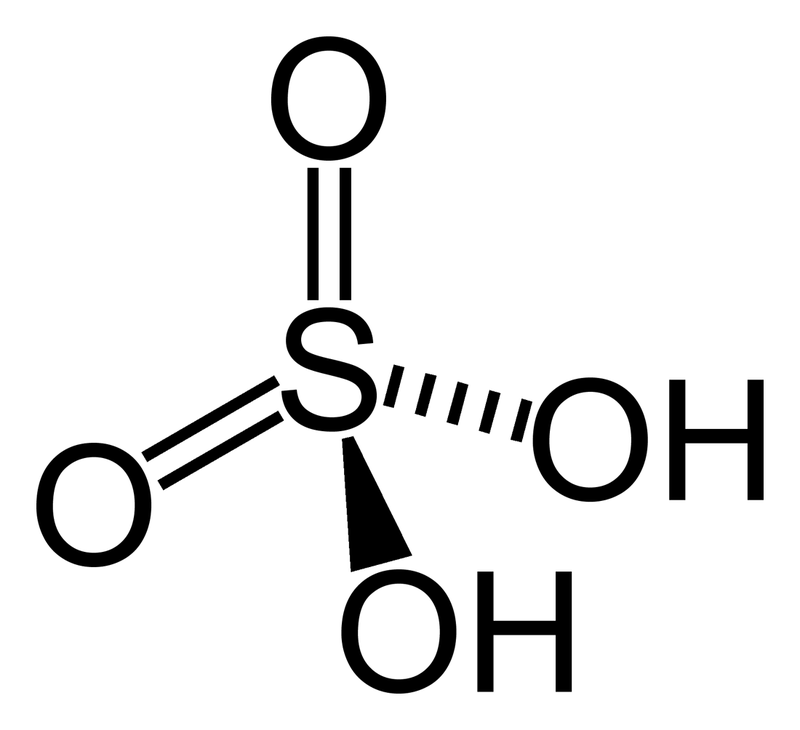
Siarka w kwasie siarkowym (VI) jest na VI stopniu utlenienia.
Temperatura topnienia czystego kwasu siarkowego (VI) wynosi ok. 10 ºC, temperatura wrzenia jest równa 337 ºC.
Kwas siarkowy (VI) ulega dwustopniowej dysocjacji, przy czym stała równowagi pierwszej reakcji jest bardzo mocno przesunięta w kierunku produktów:
H2SO4 + H2O → H3O+ + HSO−4
HSO−4 + H2O ⇌ H3O+ + SO2−4
Stężony kwas siarkowy (VI) ma właściwości silnie utleniające, może reagować m.in. ze srebrem:
2H2SO4 + 2Ag → Ag2SO4 + SO2↑ + 2H2O
Kwas siarkowy (VI) reaguje z tlenkami metali i ich wodorotlenkami, tworząc sole. Wypiera również słabsze i mniej lotne kwasy z ich soli.
Kwas działa żrąco na związki organiczne m.in. niszczy strukturę białka. Wynika to z silnej higroskopijności kwasu – „pobiera” on ze związków tlen i wodór, które budują cząsteczki wody, pozostawiając jedynie węgiel - prowadzi do ich zwęglenia.
Kwas siarkowy (VI) ma szerokie zastosowanie w przemyśle – używany jest m.in. do produkcji włókien sztucznych, barwników, nawozów sztucznych, środków piorących oraz leków. W syntezie organicznej wykorzystywany jest do sulfonowania oraz nitrowania.
Kwas siarkowy (II) (kwas sulfoksylowy, wzór sumaryczny - H2SO2 ) jest bardzo słabym kwasem nieorganicznym. Ma silne właściwości redukujące. Wodne roztwory kwasu sulfoksylowego i jego soli są nietrwałe. Jego masa molowa wynosi 66,08 g/mol.

Siarka w kwasie siarkowym (II) jest na II stopniu utlenienia.
Kwasy siarkowe Wasze opinie