Woda (inaczej - tlenek wodoru, wzór sumaryczny - H2O) jest polarnym, nieorganicznym związkiem chemicznym, który w warunkach standardowych (tj. temp. - 273,15 K, ciśnienie - 105 Pa) ma postać przezroczystej, bezsmakowej i bezzapachowej cieczy. Jest określana jako jedna z najbardziej rozpowszechnionych cząsteczek w przyrodzie i jest jednym z niewielu związków chemicznych, który w warunkach atmosferycznych typowych dla Ziemi występuje we wszystkich trzech stanach skupienia (para wodna, woda, lód). Ze względu na zdolności do rozpuszczania wielu substancji, pełni bardzo ważną rolę w przebiegu procesów chemicznych i biochemicznych.
Cząsteczka wody zbudowana jest z dwóch atomów wodoru i jednego atomu tlenu. Jej masa molowa wynosi 18 g/mol. Uproszczony wzór strukturalny można zapisać jako H-O-H. Woda nie ma jednak budowy liniowej – przestrzenne przypomina trójkąt, a biorąc również pod uwagę rozmieszczenie niesparowanych elektronów atomu tlenu, można ją określić jako tetraedryczną. Kąt pomiędzy wiązaniami O-H w cząsteczce wynosi ok. 105 º.
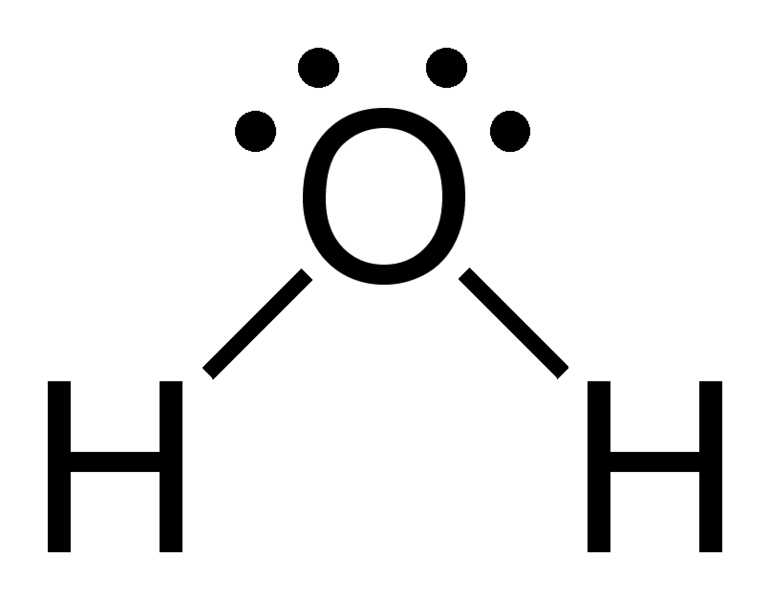
Atomy połączone są za pomocą wiązań kowalencyjnych spolaryzowanych. Polaryzacja wiązań wynika z silnej elektroujemności atomu tlenu (zdolności do przyciągania elektronów). Specyficzne rozmieszczenie powłok elektronowych wokół atomów sprawia, że cząsteczka wody jest dipolem elektrycznym, tj. posiada dwa bieguny - ujemny na atomie tlenu oraz dodatki na atomach wodoru. Cecha ta sprawia, że pomiędzy atomami wodoru jednej cząsteczki wody a atomami tlenu drugiej mogą tworzyć się wiązania wodorowe – słabe oddziaływania o charakterze elektrostatycznym. Oddziaływania te pełnią kluczową rolę w wielu właściwościach fizykochemicznych wody.
Dzięki obecności wiązań wodorowych pomiędzy cząsteczkami wody, pomimo niskiej masy cząsteczkowej, związek ten występuje w warunkach normalnych w stanie ciekłym. Dla porównania metan, posiadający taką samą masę cząsteczkową (tj. 18 Da), jest gazem.
Wiązania wodorowe wpływają również na gęstość wody, która w odróżnieniu od innych cieczy, nie rośnie jednostajnie wraz ze spadkiem temperatury. Woda osiąga swoją największą gęstość w temperaturze ok. 4 ºC (1 kg/l), a nie jak by się mogło wydawać w okolicy 0 ºC, gdy następuje przejście w ciało stałe. Lód ma mniejszą gęstość od wody, dlatego unosi się na jej powierzchni. Wynika to z faktu, że w strukturze lodu każda cząsteczka wody jest połączona wiązaniami wodorowymi z czterema kolejnymi i odległości pomiędzy nimi są relatywnie duże. Wraz ze wzrostem temperatury (w przedziale 0-4 ºC) następuje rozerwanie części wiązań i większe upakowanie cząsteczek, przy jednoczesnym wzroście płynności struktury. Dopiero w temperaturze powyżej 4 ºC drgania poszczególnych cząsteczek wody, związane z rozszerzalnością cieplną, doprowadzają do spadku gęstości wraz ze wzrostem temperatury.
Poza temperaturą duży wpływ na stan skupienia wody ma wartość ciśnienia. Relacje pomiędzy tymi dwoma parametrami bardzo dobrze obrazuje wykres fazowy wody:
https://pl.m.wikipedia.org/wiki/Plik:Diagram_fazowy_wody.svg
W warunkach normalnego ciśnienia tj. 1 atm. woda wrze w temperaturze ~100 ºC, a topnieje przy ~0 ºC. Zmiany ciśnienia wpływają na wartości tych parametrów - z tego powodu na terenach górskich, gdzie średnie ciśnienie jest niższe, woda wrze w niższej temperaturze. Najbardziej charakterystycznym miejscem wykresu jest punkt potrójny (0,01 ºC, 612 Pa) – wyznacza on warunki, w jakich woda może występować we wszystkich trzech stanach skupienia jednocześnie.
Skutkiem tworzenia się wiązań wodorowych w wodzie jest również jej duże napięcie powierzchniowe. Jest ono wypadkową oddziaływań elektrostatyczny pomiędzy cząsteczkami wody. Dzięki niemu woda dąży do posiadania jak najmniejszej powierzchni, dlatego krople wody przybierają kształt kuli. Napięcie powierzchniowe wody, tak jak wiele innych cech, jest zależne od temperatury – zmniejsza się wraz z jej wzrostem. Napięcie powierzchniowe decyduje też o występowaniu zjawiska włoskowatości – zdolności do poruszania się cieczy w naczyniach o bardzo małej średnicy np. kapilarach.
Woda jest również wyjątkowa pod kątem właściwości termodynamicznych. Charakteryzuje się dużym ciepłem właściwym (4187 J/(kg•K)), ciepłem parowania (2257 kJ/kg) oraz ciepłem topnienia (333,7 kJ/kg). Podniesienie temperatury wody o 1 stopień wymaga relatywnie wysokich nakładów energetycznych (ma dużą pojemność cieplną). Woda ogrzewa się dość wolno, ale i wolno oddaje zgromadzone ciepło - jest dobrym izolatorem cieplnym
Czysta chemicznie woda charakteryzuje się też bardzo małym przewodnictwem elektrycznym/elektrolitycznym. Dopiero roztwory wodne mają zdolność do przewodzenia prądu.
Woda jest bardzo dobrym rozpuszczalnikiem dla związków nieorganicznych jak i organicznych, niezależnie od ich stanu skupienia – jest określana jako rozpuszczalnik uniwersalny. Pod kątem oddziaływania z wodą związki można podzielić na hydrofilowe (polarne), tworzące z wodą roztwory rzeczywiste oraz hydrofobowe (niepolarne), niemieszające się z wodą. Odrębną grupę stanowią związki amfifilowe (np. fosfolipidy), które w obrębie jednej cząsteczki są i hydrofilowe i hydrofobowe. Szerokie spektrum substancji, które ulegają rozpuszczeniu w wodzie, sprawia, że jest ona środowiskiem wielu reakcji chemicznych oraz biochemicznych.
W roztworach wodnych można zaobserwować proces dysocjacji elektrolitycznej. Jest to rozpad cząsteczek, w których występują wiązania jonowe (lub kowalencyjne silnie spolaryzowane), na jony (kationy i aniony). Proces ten zachodzi pod wypływem cząsteczek rozpuszczalnika tj. wody, które otaczają powstałe jony, tworząc wokół nich tzw. płaszcz wodny (następuje ich hydratacja). Dysocjacja elektrolityczna jest procesem odwracalnym.
Sama woda również ulega dysocjacji. Proces ten określany jest mianem autodysocjacji.
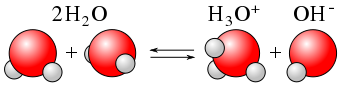
Zachodzi tylko w stanie ciekłym wody. Dzięki tej właściwości woda ma tak dobre zdolności do rozpuszczania związków jonowych. Stała równowagi autodysocjacji wody stanowi podstawę skali pH. Odczyn wody czystej chemicznie wynosi 7 pH.
W procesach chemicznych woda pełni głównie rolę środowiska reakcji. Jest produktem takich procesów jak reakcje zobojętniania, reakcje kondensacji w chemii organicznej.
Syntezę wody można przeprowadzić przez spalanie wodoru w atmosferze tlenu (mieszanina piorunująca). Jest to reakcja silnie wybuchowa.
Woda Wasze opinie