Prawo rozcieńczeń Ostwalda to wyrażenie matematyczne łączące wzory na stopień i stałą dysocjacji. Wyrażenie ma postać:
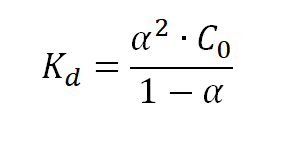
gdzie Kd to stała równowagi, α stopień równowagi a C0 to stężenie początkowe.
Dla elektrolitów słabych, (których α < 5% i stosunek C0/Kd >= 400) wyrażenie przyjmuje postać:
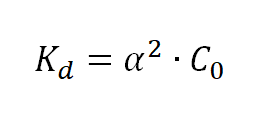
Zadanie
Roztwór pewnego kwasu jednoprotonowego o stężeniu jonów H+ 0,03M ma stopień dysocjacji równy 3%. Oblicz stałą dysocjacji tego kwasu.
Rozwiązanie
Dane:
[H+] = 0,03 mol/dm3
α = 1,5%
Kd = ?
Wzór na stopień dysocjacji dla jednoprotonowych kwasów ma postać:

Omawiany elektrolit jest słaby, ponieważ α < 5%, dlatego można skorzystać z uproszczonego wyrażenia na prawo rozcieńczeń Ostwalda.
α = [H+]/C0 -> C0 = [H+]/ α
C0 = 0,03 mol/dm3 / 1,5% = 2 mol/dm3
Kd = α2 * C0
Kd = 0,0152 * 2 mol/dm3 = 4,5 * 10-4
Odpowiedź: Stała dysocjacji dla omawianego kwasu wynosi 4,5 * 10-4.
Jak obliczyć prawo rozcieńczeń ostwalda - wyniki
Czemu w półroczu jest alfa=3℅ a podczas rozwiązywania 1.5%